Reaktionshastighed
Contents
Status & Planer
Forløbet reaktionshastighed og ligevægt foretages i 2a og 2b på Lemvig Gymnasium i efteråret 2017. Først afprøves forløbet i emnet reaktionshastighed inkl. modellen i NetLogo i 2a. Derefter vil der være mulighed for tilretning af modellen og af andet materiale til eleverne - før forløbet afprøves i 2b. Dernæst vil modellen til ligevægt inddrages under ligevægtsforløbet i begge klasser.
Introduktion
Der tages udgangspunkt i emnerne Reaktionshastighed og Ligevægt i kemi. Disse emner kan forekomme abstrakte for eleverne, og håbet er at CT kan være med til at eleverne får en bedre forståelse af de central begreber i emnerne. Derfor bruges modeller i NetLogo (et agentsbaseret programmeringsmiljø) til simulering af kemisk reaktionshastighed samt kemisk ligevægt.
Ved at anvende agentbaseret modellering er det tydeligere for eleverne hvordan elementerne (agenterne) skabes og hvilke egenskaber og opførelse de har. Eleverne kan følge en agent (f.eks en natriumion), både i interface'et og i code'en og derved afgøre om agentens opførelse og egenskaber er i overnesstemmelse med den faglige teori i faget.
Eleverne har herved mulighed for at se effekten af, hvad der sker på det mikroskopiske niveau, i det makroskopiske niveau, og for at se hvad et indgreb på det mikroskopiske niveau betyder for det makroskopiske fænomen.
Reaktion
Der tages udgangspunkt i nedenstående reaktion mellem dihydrogen og diiod: H2(g) + I2(g) ⇌ 2HI (g)
- Udgangspunktet er at temperaturen er 425,4 grader C.
- Ligevægtskonstanten K for denne reaktion ved denne temperatur er 54,4.
- Ligevægtskonstanten K for denne reaktion ved en temperatur på 500 grader K er 160.
Faglig læring (kemi)
Modellen og forløbet er udviklet for at fremme indlæring i emnet reaktionshastighed. Og CT?
Der fokuseres på nogle af de faktorer der påvirker reaktionshastigheden af en kemisk reaktion. Det drejer sig om kvalitative beskrivelser fremfor kvantitative (reaktionskinetik). Nedenfor er de faglige mål for eleverne beskrevet kort.
- Partikler (her molekyler) som støder sammen kan reagere med hinanden
- Reaktioner kan forløbe hurtigt eller langsomt
- Reaktionshastighed af en kemisk reaktion afhænger af
- Reaktanternes koncentration
- Temperatur
- Katalysator
Reaktanternes koncentration: Et øget antal reaktanter giver en øget reaktionshastighed (flere sammenstød pr. tid som vil give en øget reaktionshastighed)
Temperatur: En øget temperatur giver en øget reaktionshastighed (jo højere temperatur → jo højere gennemsnitlig kinetisk energi har partiklerne, dvs. jo højere hastighed → jo voldsommere sammenstød mellem partiklerne → jo flere sammenstød vil have energi nok til at klare ”energibjerget” (aktiveringsenergi) → jo flere reaktioner pr. tid)
Katalysator: Tilsætning af katalysator giver en øget reaktionshastighed (nedsætter størrelsen af ”energibjerget” (aktiveringsenergi) således at flere sammenstød ved den pågældende temperatur har energi nok til at reaktionen sker → jo flere reaktioner pr. tid).
Ligevægt
Til en ny side om en ny model
Modellen og forløbet er udviklet for at fremme indlæring i emnet ligevægt. Der fokuseres på de vigtigste begreber i kemisk ligevægt samt forskydning af ligevægt. Det drejer sig igen om kvalitative beskrivelser fremfor det kvantitative (beregning af forskydninger). Nedenfor er de faglige mål for eleverne beskrevet kort.
- Reaktioner forløber i begge retninger
- Ligevægt er derfor ikke en statisk tilstand men en dynamisk - når ligevægt er nået er reaktionshastigheden i begge retninger lige stor
- Når ligevægt er nået er forholdet mellem stofmængdekoncentrationerne af de forskellige stoffer konstant
- Ligevægtens beliggenhed afhænger af ligevægtskonstanten
- En stor reaktionshastighed ændrer ikke ligevægtens beliggenhed, men gør at man hurtigere når ligevægt
- Temperaturen har indflydelse på ligevægtens beliggenhed
- Indgreb i ligevægt og efterfølgende forskydning tilbage til ligevægtstilstanden (reaktionsbrøk; ligevægtskonstant; Le Chateliers Princip)
Visualisering reaktionshastighed
Reaktionshastighed i NetLogo - en kort introduktion til modellen i NetLogo. Hvad menes der med dette?
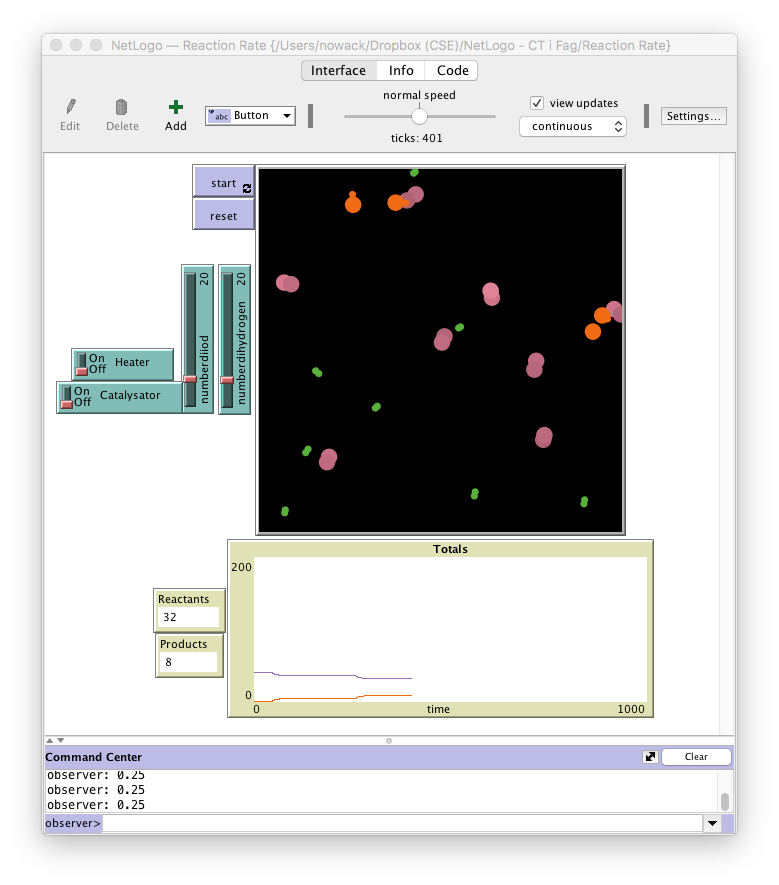
Reaktionsbeholder
- En blanding af partikler i en lukket beholder
- Dihydrogen vises som to små grønne kugler
- Diiod vises som to større lilla kugler
- Hydrogeniodid vises som en lille grøn kugle sammen med en større lilla kugle
Indstillinger
- Mulighed for at ændre antallet af reaktanter og produkt før reaktion
- Mulighed for at øge temperaturen
- Mulighed for at tilsætte en katalysator
Når indstillingerne er som ønsket trykkes på "Reset". Derefter trykkes på "Start".
Når simuleringen skal stoppes trykkes igen på "Start".
Grafer
- Viser reaktanters og produkters koncentration (antal) som funktion af tiden
Line: Det ser ud til at der hurtigere opnås et kryds af reaktanter og produkter når "heater" ikke er slået til. Dette strider imod den kemiske teori.
Visualisering ligevægt
Til en ny side om en ny model
Ligevægt i NetLogo - en kort introduktion til modellen i NetLogo.
Reaktionsbeholder
- En blanding af partikler i en lukket beholder
- Dihydrogen vises som to små grønne kugle
- Diiod vises som to større lilla kugler
- Hydrogeniodid vises som en lille grøn kugle sammen med en større lilla kugle
Indstillinger
- Mulighed for at ændre antallet af reaktanter og produkt når ligevægt er nået (forskydning af ligevægt)
Grafer
- Viser reaktanters og produkters koncentration (antal) som funktion af tiden
- Viser reaktionsbrøkens (Y) aktuelle værdi
- Viser ligevægtskonstantens værdi for denne reaktion ved denne temperatur (K=54,4)
Varighed
Forløb i Reaktionshastighed strækker sig over 2-3 uger med 6 lektioner af 45 minutters varighed hver uge. Modellen introduceres i den første del af forløbet. Forløb i Ligevægt strækker sig også over 2-3 uger med 6 lektioner af 45 minutters varighed hver uge. Her vil modellen også introduceres i den første del af forløbet.
Eleverne vil arbejde med modellerne og tilhørende materiale i en dobbeltlektion som er to gange 45 minutter.
Forudsætninger
Emnerne Reaktionshastighed og Ligevægt er normalt en del af kemi på B-niveau.
Eleverne skal have adgang til egen eller skole computer samt netadgang. Der kræves ingen erfaring med programmering for at deltage i forløbet.
Aktiviteter & Materialer
Forløbet er struktureret i tre logiske klumper fordelt på fire fysiske sessioner. Se varigheden af de enkelte dele under hver aktivitet.
På en ny side til en ny model
Ligevægt
- Eleverne introduceres til begrebet ligevægt
- Demonstrationsforsøg ved tavlen (eksempelvis carbonsyre)
- Eleverne repeterer reaktionen mellem dihydrogen og diiod
- Eleverne arbejder i tomands-grupper med modellen samt arbejdsark (stilladsering)
- Opfølgning på elevernes arbejde på klassen
- Dernæst fortsætter forløbet med forsøg mm
Refleksioner over designet af forløbet
Forløbet tilgodeser bl.a. læreplanens (STX 2013) faglige mål om at "relatere observationer, model- og symbolfremstillinger til hinanden" samt kernestoffet "reaktionshastighed på kvalitativt grundlag".
Metode
Der laves en god model. Derefter konstrueres ”fejl” med de faglige mål for øje. Idéen er at designe en utilstrækkelig/fejlbehæftet/uhensigtsmæssig mm. model med henblik på elevernes læring.
Foreløbig liste over "fejl" i modellen for Reaktionshastighed:
- Fejl vedrørende Reaktionshastighed
- Molekylers bevægelse (hastighed) ændres selvom temperaturen ikke ændres
- Andre fejl
- Èn reaktion giver kun ét produkt (man får to HI-molkyler pr reaktion)
- Uhensigtmæssige farver for molekyler
- H2 og/eller I2 som én kugle
- Kugler i H2 er større end kugler i I2