Reaktionshastighed
Simulering af kemisk reaktionshastighed samt kemisk ligevægt i NetLogo
Contents
Status & Planer
Forløbet afprøves i 2a og 2b på Lemvig Gymnasium i efteråret 2017
Introduktion
Der tages i udgangspunkt i emnerne Reaktionshastighed og Ligevægt i kemi. Disse emner kan forekomme abstrakte for eleverne, og håbet er at CT kan være med til at eleverne får en bedre forståelse af de central begreber i emnerne.
Reaktion
Se side 29-32 i Basiskemi B) H2 (g) + I2 (g) ⇌ 2HI (g)
- Navnene på stofferne er dihydrogen (reaktant), diiod (reaktant) og hydrogeniodid (produkt).
- Udgangspunktet er at temperaturen er 425,4oC.
- Ligevægtskonstanten K for denne reaktion ved denne temperatur er 54,4.
Faglig læring (kemi)
Reaktionshastighed (se definition på side 7-11 i Basiskemi B)
- Partikler (her molekyler) som støder sammen kan reagere med hinanden
- Reaktionshastighed afhænger af
- reaktanternes koncentration (her antal) (side 11-12 i Basiskemi B)
- temperatur (side 16-18 + 19-22 i Basiskemi B)
- katalysator (side 22-25 i Basiskemi B).
Ad 1) Et øget antal reaktanter giver en øget reaktionshastighed (flere sammenstød pr tid som kan give reaktion vil give en øget reaktionshastighed) Ad 2) En øget temperatur giver en øget reaktionshastighed (jo højere temperatur → jo højere gennemsnitlig kinetisk energi har partiklerne dvs. jo højere hastighed → jo voldsommere sammenstød mellem partiklerne → jo flere sammenstød vil have energi nok til at klare ”energibjerget” (aktiveringsenergi) → jo flere reaktioner pr tid) Ad 3) Tilsætning af katalysator giver en øget reaktionshastighed (nedsætter størrelsen af ”energibjerget” (aktiveringsenergien) således at flere sammenstød ved den pågældende temperatur har energi nok til at reaktionen sker → jo flere reaktioner pr tid).
Ligevægt
Se evt. side 29-32 i Basiskemi A) - Reaktioner forløber i begge retninger. Ligevægt er derfor ikke en statisk tilstand men en dynamisk. Når ligevægt er nået, er forholdet mellem koncentrationen (her antallet) af de forskellige stoffer er konstant. - En stor reaktionshastighed ændrer ikke ligevægtens beliggenhed (stor K mod højre og lille K mod venstre), men gør at man hurtigere når ligevægt. - Indgreb i ligevægt og efterfølgende forskydning tilbage til ligevægtstilstanden (side 39-42 i Basiskemi B – omhandler vores reaktion)
Visualisering reaktionshastighed
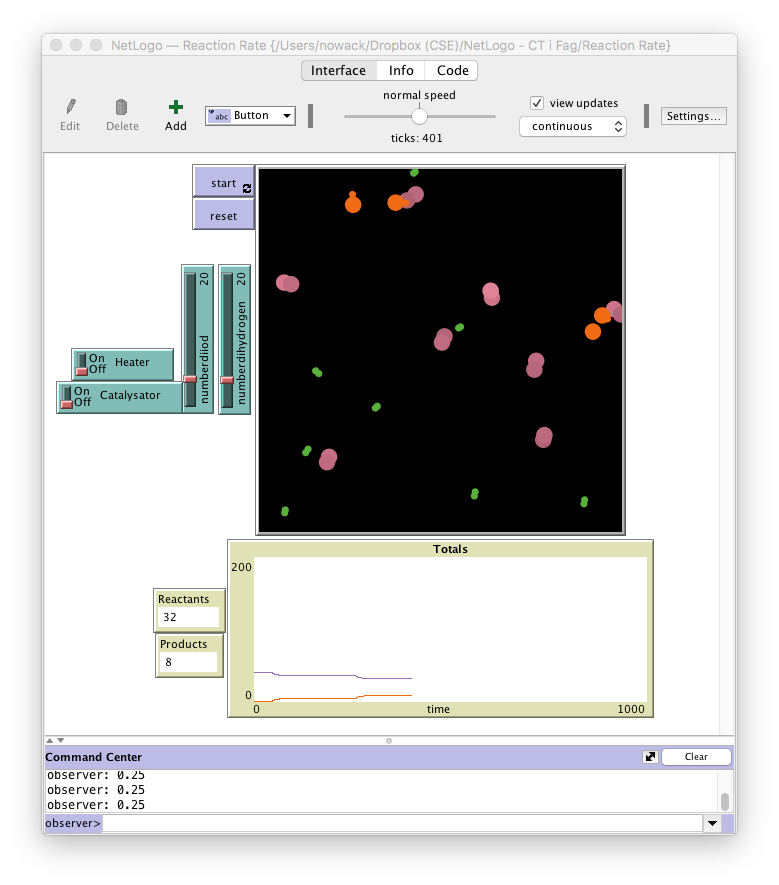
Reaktionshastighed i NetLogo Reaktionsbeholder - En blanding af partikler i en lukket beholder (støder sammen) - Dihydrogen vises som to små grønne kugle - Diiod vises som to større lilla kugler - Hydrogeniodid vises som en lille grøn kugle sammen med en større lilla kugle
Indstillinger - Mulighed for at ændre antallet af reaktanter og produkt før reaktion (man skal også kunne starte reaktionen ved kun at tilsætte HI – se tabel 2 side 31 i Basiskemi B) - Mulighed for at øge temperaturen - Mulighed for at tilsætte en katalysator
Grafer - Vise reaktanters og produkters koncentration (antal) som funktion af tiden i samme figur Her skal man kunne se at en øget reaktionshastighed giver ”stejlere kurver”. Dvs. at ved en øget reaktionshastighed skal antallet af reaktanter aftage hurtigere pr tid og antallet dannet produkt stige hurtigere pr tid (definition på reaktionshastighed side 7-10 i Basiskemi B).
Visualisering ligevægt
Ligevægt i NetLogo. Reaktionsbeholder - Som ovenfor
Indstillinger - Mulighed for at ændre antallet af reaktanter og produkt når ligevægt er nået (undervejs i reaktionen) Her vil eleverne tilsætte eller fjerne en reaktant eller produkt, og se hvordan indgrebet gør at reaktionen kommer ud af ligevægt (Y≠K), for derefter at finde tilbage til ligevægtstilstanden igen (Y=K) (se side 39-42 i Basiskemi B som omhandler vores reaktion)
Grafer - Vise reaktanters og produkters koncentration (antal) som funktion af tiden i samme figur - Vise reaktionsbrøkens (Y) aktuelle værdi (se hvordan brøken beregnes nederst side 40 i Basiskemi B) - Vise ligevægtskonstantens værdi for denne reaktion ved denne temperatur (K=54,4)
Metode
Der laves en god model. Derefter konstrueres ”fejl” med de faglige mål for øje. Idéen er at designe en utilstrækkelig/fejlbehæftet/uhensigtsmæssig mm. model med henblik på elevernes læring.
Foreløbig liste over "fejl": - én reaktion giver kun ét produkt (man får to HI-molkyler pr reaktion) - molekylers bevægelse (hastighed) ændres selvom temperaturen ikke ændres - uhensigtmæssige farver for molekyler - H2 som to bolde men I2 som én bold - H2 "bolde" større end I2 "bolde"
Links
- Kollision og reaktion samt temperatur og reaktionshastighed (denne viste jeg ikke i går). God og simpel – se og tryk på ”interpretation” undervejs: (http://www.physics-chemistry-interactive-flash-animation.com/chemistry_interactive/chemical_kinetics_factor_temperature.htm) Diverse PHET-simuleringer (Colorado University) - Reaktionshastighed (Reactions & Rates) og ligevægt (Reversible Reactions) https://phet.colorado.edu/en/simulations/category/chemistry/general
Diverse
Der skal være en grænse for hvornår reaktion sker. Kurver skal være relativt ”glatte”. Man skal kunne se partiklerne bevæge sig hurtigere ved øget temperaturen.
Varighed
Forløb i Reaktionshastighed og Ligevægt strækker sig i alt over ca. 4-5 uger. CT tages i brug undervejs til indlæring af abstrakte begreber.
Forudsætninger
De studerende arbejder med deres egne computere, hvorfor det forudsættes, at de kan installere NetLogo software på denne (alternativt findes der en webbaseret udgave af NetLogo). Adgang til små whiteboards, der bruges parvis til at lave modeller. Der er ingen faglige forudsætninger indenfor CT. De faglige forudsætninger kemi vurderes af læreren. Emnerne Reaktionshastighed og Ligevægt er normalt en del af kemi på B-niveau. I løbet af forløbet bliver de studerende bedt om at løse specifikke opgaver i NetLogo og om at gemme deres modeller som filer.
Aktiviteter & Materialer
Introduktion NetLogo
Det faglige arbejde (faglige læringsmål) stilladseres i arbejdsark til eleverne.
Eleverne får lov til at starte på og udforske modellen (med fejl). Der er dermed en relativt induktiv tilgang til læringen.